
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Реферат: Определение содержания аскорбиновой кислоты в яблоках различных сортов
Реферат: Определение содержания аскорбиновой кислоты в яблоках различных сортов
Министерство общего и профессионального образования Российской Федерации
Уральский Государственный Технический Университет – УПИ
Учебно-исследовательская работа студента по кафедре аналитической химии:
Определение общей кислотности и содержания p-активных веществ в различных сортах яблок
Выполнил:
Студент гр. Х-349
Галкин И.В.
Преподаватель:
Марина Н.В.
Екатеринбург
2000
Яблоки
Большинство зимних сортов яблок отличается невысокой С-Р витаминностью, и на них можно не останавливаться. Количество витамина С к весне обычно составляет у яблок половину бывшего к потребительской спелости – Р-активные соединения убывают за 3 – 6 месяцев холодного хранения на 15 – 30%.
Химическая классификация яблок.
1. Поливитаминные. Скрещивания основываются на объединении признаков сортов, взаимно дополняющих друг друга защитными веществами. Например, если яблоки сорта Первенец содержат много витаминов В и Р, а Полярное Олониченко много С и Р, то скрещивая их, можно получить поливитаминные гибриды, высокое содержание Р-веществ будет скрываться обилием сахаров.
2. Каротиновые. Получаются скрещиванием желтомясых крупноплодных (Эдельстенер) друг с другом. Отбор ведется по интенсивности оранжевой окраски мякоти.
3. Антоциановые. Исходные красномясые сорта Молдавии, Грузии и Казахстана. При селекции усиливается красная окраска мякоти (Р-активные соединения) и устраняется обычно низкая ее сахаристость.
4. Гематогенные. Накапливающие много фолиевой кислоты и железа.
5. Бактерицидные (эфироносные). Отличаются ароматичной мякотью и накоплением большого количества эфирных масел.
Витамины
Так называемые органические соединения, недостаток которых в пище вызывает в начале заболевания средней интенсивности (гиповитаминозы), а при длительном недостатке тяжелые заболевания (авитаминозы). Смотря по тому, какого именно витамина недоставало в пище возникают различные заболевания.
Каждый из нас нуждается в ежедневном поступлении 16 различных витаминов, два из них могут заменяться провитаминами, такими как каротин (провитамин А) и провитамин D (бета-ситостерин), которые в организме могут перехолдить в соответствующие витамины. Необходим и ряд витаминоподобных веществ в виде холина, инозита, витамина F и других.
В плодах и ягодах чаще всего присутствует два витамина, а именно: витамин С (аскорбиновая кислота) и витамин Р. Так как витаминная природа последнего многими отрицается, то вещества этого типа действия носят еще название Р-активные соединения, или полифенолы. Два универсальных витамина С и Р часто встречаются вместе и усиливают взаимное действие друг другу.
Каждый витамин должен поступать в определенном количестве. Так, например, суточная норма витамина С составляет для взрослого (но нестарого) здорового человека, занятого работой средней трудности, 75 мг. При более тяжелой физической или умственной работе или в более пожилом возрасте потребность в нем возрастает до 100 – 200 мг.
Содержание биоактивных веществ в плодах принято выражать в виде мг %, т.е. указывать, сколько мг интересующего нас соединения находится в 100 г плодов или ягод или в 100 г мякоти плодов. Иногда указывают содержание в мг в мякоти из 100 г плодов, например смородины или крыжовника. В тех случаях, когда вещества очень много, например 300 – 500 мг%, выражают его содержание в %, приравнивая каждые 100 мг% - 0.1%.
Для оценки полезности плодов как источника того или иного биоактивного соединения необходимо сопоставить суточную потребность в нем с тем его количеством, которые содержится в 250 г оцениваемых фруктов.
Вынесем сводные данные о содержании витаминов во фруктах в таблицу:
| Витамин или провитамин | Где содержится в большом количестве | Дозы в мг | |
| Профилак-тическая | Терапевти-ческая | ||
|
п-А (каротин) В2
В9 С Е Р К1 |
Шиповник, облепиха, рябина, абрикос, хурма, некоторые сливы, мандарины. Сливы, алыча, персик, шиповник, гранат Виноград, малина, земляника, вишня Шиповник, смородина черная, облепиха, земляника, цитрусовые, унаби Облепиха, миндаль, лещина, маслина, шиповник, рябина Арония, рябины мичуринские, мелкоплодные, яблоки Смородина, рябина, арония, облепиха, виноград |
3 –4 2 – 3 0.5 – 1 60 – 75 25 100 – 200 10 |
10 – 15 10 2 –3 150 – 300 100 1000 – 2000 50 |
Определение витаминов.
Особенности витаминов и методов их определения.
Среди других химических веществ растений витамины занимают особое место тем, что они, как правило, содержатся в растениях в исключительно малом количестве. Если количество белков, жиров и углеводов в растительных тканях составляет целые проценты, то количество витаминов измеряется лишь тысячными или десятитысячными долями процента. Это обстоятельство обуславливает особые требования, предъявляемые к химическим методам определения витаминов; такие методы должны отличаться высокой чувствительностью, оставаясь в то же время достаточно точными. Достигается это в большинстве случаев применением физико-химических методов анализа (хроматография, колориметрия, спектрофотометрия, флюорометрия и т.д.). Трудностью разработки простых, чувствительных и точных методов объясняется то обстоятельство, что в настоящее время мы еще не имеем надежных химических методов для количественного определения некоторых известных витаминов, несмотря на то, что химическое строение их хорошо выяснено. Для установления наличия и для количественного определения таких витаминов пока пользуются биологическими или микробиологическими методами.
Название "витамины" не отражает химического состава этих веществ. К витаминам относятся вещества самого разнообразного строения и характера, принадлежащие к различным классам органических соединений. Среди них имеются углеводороды, спирты, кислоты и т.п. Поэтому естественно, что и методы определения отдельных витаминов не сходны между собой.
Витамины синтезируются растениями. Несмотря на малое содержание их в растениях, народнохозяйственное значение их огромно; оно заключается в их роли в народном здравоохранении, связанной с проблемой питания. Огромное значение имеют витамины также и в животноводстве. Универсальное распространение витаминов и в растительном мире говорит о том, что эти вещества играют самую значительную роль также и в физиологии самих растительных препаратов.
Витамины необходимы человеку, животным и растениям для нормального роста и поддержания жизни. Значение их, как регуляторов процессов обмена веществ в организме, очень велико. Витамины являются физиологически весьма активными веществами. В живой клетке они выполняют роль биологических катализаторов, участвуя в энзиматических системах, связанных с окислительно-восстановительными функциями организма. Многие из них, в виде соответствующих деривативов, выполняют роль коферментов.
Потребность в витаминах в основном удовлетворяется продуктами сельхохозяйственного производства. Поэтому задачей сельского хозяйства, в частности растениеводства, является проведение мероприятий, обеспечивающих высокое содержание витаминов во всех видах продукции, используемых в пищевых и кормовых целях и служащих сырьем для витаминной промышленности. Эту задачу нельзя разрешить без наличия быстрых и точных методов количественного учета витаминов в сельскохозяйственной продукции.
В настоящее время уже проведены довольно многочисленные исследования культурных и дикорастущих растений на содержание витаминов и провитаминов. Результаты этих исследований показывают, что любой витамин или его провитамин, вероятно, можно найти в любом растении. Однако количественное содержание их не одинаково у различных видов и сортов; оно сильно зависит также от воздействия внешних условий произрастания.
Отдельные ткани одного и того же растения значительно различаются по содержанию витаминов. Так, например, аскорбиновая кислота сконцентрирована в листьях и плодах; подземные части растений, как правило, содержат ее мало. Концентрация аскорбиновой кислоты больше в листьях верхних ярусов, чем нижних. Наружные слои плодов, кочанов или корнеплодов содержат ее больше, чем внутренние. Аневрин сконцентрирован преимущественно в семенах растений, в которых он находится главным образом в зародыше и в тех наружных слоях, которые при помоле отходят в виде отрубей. Некоторые количество аневрина находится в листьях, корнях и клубнях. Концентрация его в листьях и стебле постепенно снижается вниз по растению. Концентрация каротина, за редким исключением, наибольшая в зеленых листьях. Так, наружные зеленые листья кочанной капусты содержат его намного больше, чем внутренние, белые листья. Корни и клубни содержат лишь следы каротина, за исключением разве только красных корней моркови. Различные ткани корня моркови различаются по содержанию каротина.
Отдельные растения, плоды и даже отдельные семена могут значительно различаться между собой по содержанию витаминов. Между отдельными плодами существуют различия, связанные с их величиной и возрастом. Так, например, мелкие плоды и кочаны обычно содержат аскорбиновой кислоты больше, чем крупные, что, вероятно, определяется степенью их зрелости; некоторое значение приписывают и относительной величине поверхности плодов, освещаемой солнцем, которая больше у мелких плодов. По содержанию каротина были обнаружен значительные различия у плодов томата с одного и того же растения и у корней одного и того же сорта моркови при выращивании в одинаковых условиях. Различия в содержании аскорбиновой кислоты в плодах на одном растении или в плодах различных растений одного и того же сорта могут быть значительно больше, чем различия между отдельными сортами в одинаковых условиях их выращивания. Однако при правильном отборе средних проб для анализа эти различия не мешают рассматривать аскорбиновую кислоту как признак, связанные с определением биологической единицей – видом и сортом.
Изучение овощных и плодовых культур по видам и сортам дало возможность выявить образцы с высоким содержанием аскорбиновой кислоты. Так например некоторые виды дикого картофеля содержат в 2-3 раза больше аскорбиновой кислоты, чем обычные селекционные сорта; среди послдених также обнаружены значительные различия. Широкая амплитуда сорртовой изменчивости по этому витамину обнаружена у капусты (особенно кочанной) и томатов. Это указывает на большие возможности селекции путем отбора и выведения новых витаминных форм растений путем гибридизации.
Изучение сортовой изменчивости содержания витаминов в культурных растениях показывает, что сортовые различия резко выявляются только в более или менее одинаковых условиях среды. Внешние условия даже в одном и том же пункте значительно меняются, вследствие чего изменяется и содержание витаминов. Поэтому при исследовании культур и сортов в отношении витаминов постоянно следует учитывать влияние условий выращивания. Было бы неправильно говорить о сортовых различиях культур в отношении витаминов, не указывая конкретно где, в каких условиях выращивались растения, ибо в других условиях сортовые различия могут быть иные.
На большое значние условий среды для накопления в растении витаминов указывает изменчивость содержания последних в одном и том же сорте при выращивании в различных географических пунктах. Так, например, найдено, что сорта яблок, произрастающие на юге (Кавказ, Крым, Средняя Азия), содержат аскорбиновой кислоты меньше, чем произрастающие на севере. Аналогичная изменчивость была обнаружена и в отношении содержания этого витамина в плодах северных и южных видов шиповника.
Влияние географического фактора наблюдается не только при передвижении с севера на юг, но и в зависимости от высоты местности над уровнем моря. Так, было обнаружено для овощей, выращенных на Памире, увеличение содержания витамина С с высотой; на высоте 3860 м капуста, шпинат и салат содержат витамина С в 2-3 раза больше, чем в долине. Южные высокогорные виды шиповника по содержанию этого витамина не уступают северным шиповникам.
Изменчивость содержания других витаминов под влиянием различных условий среды освещена еще очень мало. Имеющиеся данные показывают, что неодинаковость условий мест произрастания может оказывать значительное влияние на содержание аневрина в зерне пшеницы и ржи, чем видовой или сортовой фактор. На накопление каротина в плодах, очевидно, влияют световые условия. Так, было найдено, что томаты несколько снижают содержание каротина при выращивании в закрытом грунте.
Наибольшее влияние на биосинтез аскорбиновой кислоты, очевидно, оказывает интенсивность света. Было показано, что после увеличения интенсивности света в 25 раз содержание аскорбиновой кислоты в листьях турнепса увеличивается в 8.3 раза (от 28.2 до 235 мг%). Показано также, что определенное значение имеет фотопериод. Что касается влияния различного спектрального состава света, то на основании довольно ограниченных данных можно полагать, что биосинтезу аскорбиновой кислоты более способствуют длинноволновые, чем коротковолновые лучи спектра.
Определение аскорбиновой кислоты (витамина С)
Недостаток аскорбиновой кислоты в пище человека ведет к развитию ряда недомогания, приводящих постепенно к тяжелой болезни – цынге.
Симптомы гиповитаминоза следующие: общая слабость, легкая утомляемость, вялость, сонливость (особенно весной), сердечная недостаточность. Снижается устойчивость к различным заболеваниям, в том числе простудным. Замедляется заживление ран и выздоровление при различных болезнях. Ухудшается общее самочувствие. Усиливаются склеротические изменения в сосудах. Увеличивается содержание холестерина в крови, и развивается холестериновый атеросклероз. Происходят частые кровоизлияния из носа. Появляются синие пятнышки на коже (синяки без ушибов). Усиливается гипертония. Возникают боль и кровотечения десен, кариес, расшатывание и выпадение зубов.
Аскорбиновая кислота (С6Н8О6) образует бесцветные кристаллы и является одноосновной кислотой, дающей соли, типа С6Н7О6М.
Аскорбиновая кислота отличается непрочностью вследствие наличия двойной связи в молекуле. Она способна обративо окисляться и восстанавливаться. При обратимом окислении образуется дегидроаскорбиновая кислота (С6Н6О6), что обуславливается наличием в молекуле редко встречающейся в природе эндиольной группировки.
Последняя способна чрезвычайно легко окисляться в дикетогруппировку, обуславливая тем самым исключительную восстановительную способность аскорбиновой кислоты. Молекулярный вес аскорбиновой кислоты 176, эквивалентный вес 88. Она легко растворима в воде и в метиловом спирт, но в высших спиртах (например амиловом) почти нерастворима. Умеренно растворима в ацетоне и совсем нерастворима в безводном серном эфире и петролейном эфире.
Наиболее характерным свойством аскорбиновой кислоты является ее способность давать химически и термодинамически обратимую ОВ-систему; с этим свойством обычно связывают ее физиологическую функцию.
Количественное определение аскорбиновой кислоты
Принцип метода.
Метод основан на редуцирующих свойствах аскорбиновой кислоты. Синяя краска (индикатор), 2,6-дихлорфенолиндофенол, восстанавливается в бесцветное соединение экстрактами растений, содержащими аскорбиновую кислоту (реакция Тильманса).
2,6-дихлорфенолиндофенол показывает два вида реакции. Один вид обусловливается изменением pH среды, как у обычных ацидометрических индикаторов; при этом происходит переход от интенсивного синего цвета в щелочной среде к бледнокрасному в кислой среде. Переход окраски происходит между рН 4 и 5, в этом интервале индикатор имеет фиолетовый цвет. Второй вид реакции – это ОВ-переход от темносинего окисленного состояния к бесцветному. Эту последнюю реакцию и используют для определения аскорбиновой кислот. Кислотные вытяжки из растений титруют раствором индикатора (известного титра) до наступления розового окрашивания, обуславливаемого избытком индикатора в кислой среде. На одну молекулу аскорбиновой кислоты (молекулярный вес 176) приходится две молекулы индикатора. При приготовлении этой краски получается натриевая соль 2,6-дихлорфенолиндофенола, имеющая молекулярный вес 290.
Точность метода во многом зависит от применяемой техники анализа. Так как аскорбиновая кислота является весьма лабильным веществом, то в растертой растительной ткани она быстро окисляется, превращаясь в дегидроаскорбиновую кислоту. Поэтому все операции, связанные со взятием средней пробы материала для анализа, измельчением и растиранием навески и т.п., должны быть выполнены возможно быстрее. Дегидроаскорбиновая кислота может быть определена после восстановления ее, например, сероводородом, что в значительно степени усложняет технику анализа. Дегидроаскорбиновая кислота в небольших количествах присутствует и в нерастертых тканях растений, но ввиду сравнительно незначительного содержания ее можно и не учитывать при выполнении массовых анализов культур и сортов на аскорбиновую кислоту.
При оценке свежего растительного материала не допускается предварительная сушка его или какой-либо друго способ консервирования, так как количество аскорбиновой кислоты при консервировании уменьшается.
Такие объекты, которые обладают очень короткой лежкостью (листовые овощи, мелкие плоды, ягоды и пр.), следует анализировать в день их сбора, так как изменения в содержании витаминов в них происходят быстро.
Реактивы и аппаратура.
1) 1-процентная соляная кислота (23 мл концентрированой соляной кислоты, удельного веса 1.19 доводят дистилированной водой до 1 л);
2) 2-процентная метафосфорная кислота (НРО3) ; 20 грамм кристаллической кислоты растворяют и доводят водой до 1л; она может хранится в холодильнике 2-3 недели, не подвергаясь порче; 1-процентный водный раствор щавелевой кислоты может заменить метафосфорную;
3) 2-процентная серная кислота; 11.4 мл концентрированной кислоты, удельного веса 1.84, доводят водой до 1 л;
4) аскорбиновая кислота, кристаллическая;
5) иодистый калий, кристаллический;
6) крахмал, 1-процентный раствор (как индикатор);
7) 10-процентный раствор сернокислой меди (9.25 г CuSO4 × 5H2O растворяют в 50 мл воды);
8) 0.001 н. раствор иодата калия (KJO3); на аналитических весах берут 0.3568 г иодата, высушенного в течение 2 часов при 102о, растворяют и доводят водой до 1л; полученный таким образом децинормальный раствор разбавляют в 10 раз и доводят водой до 1л; раствор удобно хранить в склянке со вставленной в нее микробюреткой, наполняющейся раствором снизу при помощи груши;
9) 0.001 н. раствор 2,6-дихлорфенолиндофенола; на технических весах отвешивают 60 мг сухой краски, переносят в мерную колбу на 200 мл, прибавляют 100-150 мл теплой дистилированной воды и 4-5 капель 0.01 н. щелочи; сильно взбалтывают колбу руками 10 минут, затем доливают до метки водой и фильтруют через плотный фильтр в сухую колбу;
10) 2 микробюретки с градуировкой на 0.01 мл, емкостью 1-5 мл.
11) пипетки на 5 и 10 мл;
12) мерные колбы на 100, 200 и 1000 мл;
13) коническая колба на 100 мл;
14) мерный цилиндр на 50 мл;
15) химические стаканы на 50 мл;
16) стеклянная воронка;
17) часовое стекло
18) фарфоровые чашки диаметром 20 см;
19) ступка диаметром 15 см;
20) технохимические весы на 200 г;
21) нож из нержавеющей или хромированной стали.
Установление титра краски по аскорбиновой кислоте (по С.М.Прокошеву). Метод установления титра краски основан на параллельном титровании раствора аскорбиновой кислоты краской и 0.001 н. раствором иодата калия. Так как 1 мл 0.001 н. раствора иодата эквивалентен 0.088 мг аскорбиновой кислоты, то легко рассчитать титр краски.
Перед установлением титра краски растворяют несколько кристалликов аскорбиновой кислоты приблизительно в 50 мл 2-процентной серной кислоты. 5 мл этого раствора титруют краской из микробюретки. Тотчас же после этого такой же объем раствора аскорбиновой кислоты титруют из другой микробюретки точно 0.001 н. раствором иодата с прибавлением в колбочку перед титрованием нескольких кристалликов (около 5-10 мг) иодистого калия и 5 капель 1-процентного раствора растворимого крахмала. Применение больших концентраций иодистого калия недопустимо, ибо при высоких концентрациях этой соли сильно тормозится оксисление аскорбиновой кислоты иодом.
Подготовка материала.
Среднюю пробу предварительно грубо измельчают ножом на стеклянной пластине, либо фарфоровой чашке. Необходимо помнить, что следы железа и меди катализируют разрушение витамина С. Весь процесс измельчения необходимо выполнить как можно быстрее.
Из измельченного и хорошо перемешанного материала берут на часовые стекла две параллельные навески на технохимических весах для определения аскорбиновой кислоты. При одновременном анализе нескольких образцов следует стремиться все навески для определения аскорбиновой кислоты сразу залить кислотой и после уже растирать до образования гомогенной смеси.
Ход определения.
Приготовление вытяжек.
Навеску исследуемого материала в 5-10 г заливают в ступке 20 мл 1-процентной соляной кислоты и быстро растирают в присутствии кислоты до образования гомогенной массы. Процесс растирания не должен длиться больше 10 минут. Полученную массу сливают из ступки (через стеклянную палочку и воронку) в мерную колбу на 100 мл. Ступку споласкивают несколько раз 2-процентной метафосфорной кислотой, которую выливают в ту же мерную колбу. Содержимое колбы доводят до метки 2-процентной метафосфорной кислотой, колбу закрывают пробкой, сильно встряхивают и оставляют стоять около 5 минут. Затем содержимое колбы выливают на сухой фильтр и отфильтровывают часть экстракта (около 50 мл) в сухой стакан или колбу.
Соляная кислота извлекает из растительной ткани как свободную, так и связанную аскорбиновую кислоту. Метафосфорная же кислота осаждает белки и улучшает стойкость аскорбиновой кислоты в экстрактах.
Метафосфорная кислота не извлекает связанной аскорбиновой кислоты из тканей. Поэтому если хотят определить отдельно свободную форму аскорбиновой кислоты, то экстракцию материала производят одной только 2-процентной метафосфорной кислотой. По разности же между результатами титрования экстрактов, полученных путем использования для экстракции смеси соляной и метафосфорной кислот и одной метафосфорной килоты, узнается количество связанной аскорбиновой кислоты.
Определение аскорбиновой кислоты в окрашенных вытяжках (по И.К. Мурри).
Многие растительные материалы дают окрашенные экстракты, что затрудняет определение аскорбиновой кислоты путем прямого титрования краской (2,6-дихлорфенолиндофенолом). При анализе таких объектов аскорбиновую кислоту в экстракте окисляют краской, прибавляя значительный избыток ее. Избыток краски извлекают из экстракта таким растворителем, который сам не растворим в воде, растворяет краску и не растворяет пигментов экстракта. По разности между количеством прибавленной к экстракту краски и ее остатком после реакции (определенном колориметрически) узнают какое количество краски идет на окисление аскорбиновой кислоты.
Ход определения
10 г исследуемого материала экстрагируют 2-процентной метафосфорной кислотой и доводят объем экстракта кислотой до 100 мл. После фильтрования берут градуированный пипеткой определенный объем окрашенного экстракта и наливают в мерный цилиндр. Туда же наливают 2 мл 0.001 н. раствора краски и хорошо перемешивают. Через 2 минуты приливают пипеткой 10 мл. смеси толуола и изобутилового спирта, закрывают цилиндр пробкой и осторожно взбалтывают опрокидыванием его в руках 8-10 раз. Оставляют в покое до полного разделения слоев. Избыток краски переходит в верхний слой и окрашивает его в красный цвет (в темном месте интенсивной краски не изменяется в течение нескольких часов). Часть раствора наливают в колориметрическую пробирку и колориметрируют. Для удобства наливания лучше удалить шариковой пипетко из цилиндра водный, нижний, слой. Раствором сравнения, наливаемым в другую колориметрическую пробирку, служит раствор краски, который приготовляется так же, как опытный раствор, с той лишь разницей, что вместо растительного экстракта берут равный объем щавелевой или метафосфорной кислоты, которой пользовались при экстрагировании исследуемого материала.
Определение дегидроаскорбиновой кислоты.
Дегидроаскорбиновая кислота в небольшом количестве обнаружена во многих растениях, ее наличие связано с физиологической ролью витамина С в растительных тканях. При обычной оценке растительного сырья по содержанию витамина С можно ограничиваться определением восстановленой формы аскорбиновой кислоты ввиду незначительного содержания дегидроаскорбиновой кислоты. Дегидроаскорбиновая кислота может образовываться в довольно значительных количествах во время слишком длительнго растирания и измельчения растительной ткани переда анализом благодаря соприкосновению с атмосферным кислородом и активности окислительных ферментов.
Так как дегидроаскорбиновая кислота не титруется 2,6-дихлорфенолиндофенолом, то она может быть определена только после восстановления ее в аскорбиновую кислоту.
Принцип метода
Сначала определяют в растительном экстракте описанным выше методоа содержание восстановленой аскорбиновой кислоты. Затем в том же экстракте дегидроаскорбиновую кислоту восстанавливают в аскорбиновую кислоту сероводородом и снова определяют общее содержание восстановленой аскорбиновой кислоты. По разности между вторым и первым определениями узнается количество дегидроаскорбиновой кислоты в экстракте.
При определении всех формы аскорбиновой кислоты (свободной, связанной и дегидро-формы) количество фильтрата 100 мл может оказаться недостаточным, в таком случае следует увеличить величину навески и объем экстракта, сохраняя их изначальное соотношение.
Ход определения.
Наливают в стакан 50 мл. профильтрованного растительного экстракта. Через экстракт пропускают сероводорода в течение 20 минут (работа ведется в вытяжном шкафу). Сероводород должен проходить через экстракт непрерывно. Затем для удаления сероводорода через экстракт пропускают углекислоту. Полноту удаления сероводорода через экстракт контролируют уксусно свинцовой бумажкой, почернение которой указывае на наличие сероводорода. После полного удаления сероводорода экстрак, если он мутный, фильтруют, а при наличии центрифуги – центрифугируют. Затем берут две параллельные порции экстракта по 10 мл и титруют краской как обычно.
Если необходимо определить количество титруемых краской посторонних примесей, то к другим 2 параллельным порциям по 10 мл прибавляют 0.1 мл 10-процентного раствора сернокислой меди, нагревают 10 минут при 110 градусах, охлаждают и титруют краской. Полученную поправку вычитают из результата первого титрования и узнают сумму восстановленной и дегидроаскорбиновой кислоты в мг%. По разности между этой величиной и количеством мг% восстановленой формы аскорбиновой кислоты (определенно до обработки сероводородом) узнается количество дегидроаскорбиновой кислоты.
Определение активной кислотности
Биологическое значение активной кислотности.
Биологическое значение концентрации водородных ионов в растительных тканях очень велико. Многие ферментативные процессы в растениях регулируются реакцией среды, которая создается в результате поступления и образования различных веществ (минеральных солей, органических кислот). Скорость различных биохимических процессов управляется активной кислотностью среды.
Культурные растения и их сорта в процессе своего формирования (как биологических особей) приспособились к определенной активности кислотности почвы. Например, местные сорта, сложившиеся в результате длительного возделывания на кислых почвах слабо реагируют на известкование почв, тогда как сорта, сформировавшиеся (в условиях разделывания) на нейтральных почвах, сильно реагируют на известкование кислых почв.
Точный метод определения концентрации водородных ионов может быть использован не только для характеристики культур и соротов, но и в качестве биохимического метода контроля над происходящими изменениями в растительных материалах в процессе их переработки. Например, в соке свежеполученной мезги корнеплода свеклы был получен рН 6.00, по истечении же четырех часов хранения мезги в отжатом из нее соке был найден рН 6.30. В измельченных листьях шпината и подсолнечника также наблюдаются сдвиги в нейтральную и щелочную сторону. В неизмельченных листьях происходят другие изменения в концетрации водородных ионов, чем в измельченных. По характеру и быстроте сдвигов в концентрациях водородных ионов можно судить о сортовых различиях.
Поскольку эти различия связаны с характером окислительно-восстановительных и других процессов, то определение рН дает возможность быстро установить происходящие изменения. Таким образом, определение рН может служить для контроля.
Следует также подчеркнуть большое значение определении рН для различных биохимических процессов, например, при определении ферментов, витаминов и в других анализах.
Необходимо отметить, что рН вытяжек или суспензий зерна изменяется в относительно узких пределах вследствие большой буферной способности белковых веществ и фосфатов.
Понятие об активной кислотности.
Вода и водные растворы диссоциирующих веществ в той или иной степени ионизированы. В воде непрерывно протекает процесс диссоциации воды на водородный и гидроксильный ионы и рекомбинация этих ионов в недиссоциированные молекулы воды. Скорость распада воды на ионы пропорциональна действующей массе реагирующих молекул воды, а скорость рекомбинации воды пропорциональна произведению действующих масс реагирующих ионов. Это состояние выражается формулой
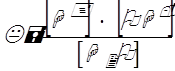 ,
,
где К – константа диссоциации, а символы в квадратных скобках – концентрации соответствующих ионов и молекул.
Кислоты в водных растворах диссоциируют на водородный ион и отрицательно заряжнный остаток кислоты. Сильные кислоты почти нацело диссоциированы на ионы, а слабый – диссоциированы в слабой степени. Наприме, 0.1 н. раствора HCl диссоциирован на 91 %, а такой же раствор уксусной кислоты только на 1.36%. Следовательно, сила кислот зависит не от общего количества находящегося в них водорода, а только от ионов водорода. От концентрации водородных ионов зависит истинная кислотность или щелочность среды.
В настоящее время принято обозначать концентрацию водородных ионов символом рН для растворов не крепче нормального. Численное выражение рН представляет собой десятичный логарифм числа, показывающего количество граммов водородных ионов в 1л. При этом отрицательный знак опущен.
Понятие о буферности
Измерение рН растворов сильных кислот в присутствии слабых концентраций солей этих кислот показывает, что концентрация водородных ионов изменяется мало (при разбавлении растворов). Совсем иначе обстоит дело для растворов слабых кислот и их солей. Величина рН слабых кислот в значительной степени зависит от присутствия в растворе щелочных солей этих кислот. Прибавление щелочных солей в растворы слабых кислот может изменить рН на несколько единиц от рН первоначального раствора. Величина концентрации протонов, соответствующая сильнокислой реакции, может быть достигнута прибавление кислот, более сильная щелочная область устанавливается прибавлением более сильных оснований и их солей. Все эти смеси называют буферными растворами, или смесями.
Примерное вычисление рН смесей солей и кислот может быть произведено по простейшей формуле
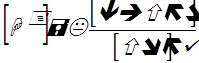 , где
, где
К – константа диссоциации.
Необходимая концентрация водородных ионов может быть произведена по нашему желанию, что имеет большое практическое значение и чем постоянно приходится пользоваться.
Смеси кислот с их солями (буферные смеси) обладают важным свойством, состоящимх в устойчивом сохранении [H×] при сильных разведениях. Это свойство представляет большую практическую ценность. Однако буферное действие этих разбавленных растворов понижается. Всякий буферный раствор может нейтрализовать только известное предельное количество кислоты или щелочи т.е. обладает определенной буферной емкостью. Емкость буфера тем больше, чем больше молей буферного вещества будет содержаться в данном растворе. Вытяжки из некоторых растительных объектов обладают значительной буферностью.
Определение концентрации водородных ионов
Для определения рН существует много методов, основывающихся на электрометрических и колориметрических принципах. Хорошие результаты могут быть получены при определении рН по колориметрическому метода Михаэльса с набором индикаторов и цветной шкалы в пробирках. Для более точных определений рН необходимо пользоваться электрометрическим методом. Существующие в настоящее время приборы, потенциометры, позволяют производить определение рН достаточно быстро и точно.
Их колориметрических методов удобны для пользования методы с индикаторными бумажками, пропитанными индикаторами (колориметр Вульфа), или с набором индикаторных карандашей (колориметр, предложенный Е. Хорошей). Эти методы отличаются широкой возможностью применения в тех случаях, когда точность определения рН достаточна от 0.1-0.2, так как ошибка в определении рН возможна в этих пределах. В ряде случаев такая точность является удовлетворительной. При изучении биохимических процессов необходима большая точность.
Определение рН при помощи карандашного колориметра.
Весь прибор заключен в коробку размером 9х17х5 см и состоит из набора 6 индикаторных карандашей и 6 цветных шкал, для сравнения объединенных попарно, предметного стеклышка, стеклянной палочки и фильтровальной бумаги.
Метод основан на измерении окраски индикатора, нанесенного карандашом тонким слоем на смоченную опытным раствором фильтровальную бумагу, под влиянием рН этого раствора. Каждый карандаш чувствителен только в определенном пределе шкалы рН и каждому карандашу соотвествует своя шкала, обозначенная одним и тем же номером
Предельные значения чувствительности каждого карандаша:
№1………………….1.2-2.4 №4………………………………6.6-8.6
№2………………….2.6-5.0 №5………………………………8.6-10.4
№3………………….5.2-6.6 №6………………………………10.6-12.6
Этот метод применим для приготовления растворов с определенными границами рН, для быстрых ориентировочных определений в полевых условиях и экспедициях, для быстрых но приближенных определений рН в соках и мезге, особенно при наличии небольших проб материала. Точность метода не превышает 0.1. Для изучения биохимических процессов необходимо применять более точные методы.
Ход определения.
На предметное стекло кладут полоску беззольной фильтровальной бумаги и смачивают ее испытуемой жикдостью до ровного увлажнения. Как только капля растеклась по всей бумажке, на ней делают карандашом несколько легких равномерных по нажиму штрихов. Ожидают некоторое время, чтобы нанесенные на бумагу штрихи приняли постоянную окраску. После этого полученные оттенок отыскивают на соответствующей взятому карандашу шкале.
Если рН жидкости приблизительно известен, то сразу выбирают карандаш, соответствующий предпологаемому рН. В случае, если рН неизвестен, определение начинают с карандаша №3 (рН 5.2 – 6.6). Если при сравнении со шкалой находят, что оттенок штриха совпадается с окраской, соответствующей рН 6.6 (или 5.2), тогда берут соседний карандаш №4 (или №2) и также наносят штрихи. В случае совпадения оттенка, соответствующего рН 6.6 (или 5.2) по другой шкале (4 и 2, с которой надлежит сравнивать оттенки), тогда истинное значение рН лежит между крайними значениями рН двух шкал. Этим методом можно определять рН взвеси, окрашенных вытяжек, соков и мезги. В случае определения рН в мезге берут полоску фильтровально бумаги шириной в 1 см и погружают ее одним концом в мезгу. Увлажнение бумаги будет быстро распространяться к противоположному концу. На эту увлажненную, но не окрашенную мезгой часть бумаги наносят штрихи индикаторным карандашом. В случае окрашенных соков или вытяжек на бумагу наносят несколько больших капель и штрихи наносят также на увлажненные, но не окрашенные части бумаги.
Электрометрическое определение рН.
Метод основан на том, что между электродом, насыщенным водородом и жидкостью, имеющией водородные ионы, возникает скачок потенциала, зависящий от концентрации последних. Потенциал электрода можно определеить с помощью другого электрода, имеющего постоянный потенциал. Последний называется стандартным полуэлементом. Если соединить два электрода, то получится элемент, ЭДС которого можно измерить. Обычно неизвестную разность потенциалов уравновешивают противоположно направленной известной. Принцип этот иллюстрируется схемой, изображенной на рис.
Здес С – свинцовый аккумулятор и х – неизвестная ЭДС, которую надо определить. СА и СБ – толстые провода с небольшим сопротивлением, которым можно пренебречь.
АБ – проволока, имеющая одинаковое поперечное сечение по всей длине. Потенциал между АБ равномерно падает вдоль проволоки. Контакт В, скользящий по проволоке, так соединен с неизвестным элементом х, что положительный полюс аккумулятора соответствует положительному полюсу элемента, а отрицательный полюс соединен с отрицательным полюсом аккумулятора.
Таким образом, в цепи Ах (через гальванометр) имеются две ЭДС: Е между А и В и между А, х и В, направленные одна против другой. Скользящий контакт двигают вдоль проволоки АБ до тех пор, пока гальванометр не укажет на отсутствие тока. Это будет тем состоянием, когда разность потенциалов уравновешена. Так как проволока АБ на всем протяжении имеет одинаковое поперечное сечение, то разность потенциалов между А и В будет (АВ:АБ)Е, где Е - ЭДС аккумулятора, а АВ:АБ – отношение сопротивления, равное отношению длин отрезков. Если вся длина проволоки равна 1000 мм, то ЭДС неизвестного элемента будет равна (АВ:1000)Е.
АВ представляет отсчет по линейке, а Е может быть легко определено переключением на место х элемента с известной электродвижущей силой (например при включении элемента Вессона).
Аппаратура – электрометрическая устновка, включающая:
1) Аккумулятор в качестве источника тока;
2) Нормальные элементы;
3) Гальванометр;
4) Каломелевые электроды;
5) Хингидронный электрод;
6) Реостаты, ключ для кратковременного включения тока, переключатели, агар-агаровые дугообразные ключи (рис. )
Аккумулятор должн иметь напряжение 2.0 В; если напряжение упало ниже 1.9 В, его необходимо зарядить вновь. ЭДС недавно заряженного аккумулятора изменяется немного при разряде в течение первых минут, поэтому рекомендуется дать разрядиться аккумулятору в течение 10 – 15 минут, включая его в систему перед измерением.
В качестве нормального элемента применяется элемент Вессона, который содержит раствор сульфата кадмия, насыщенный при всех температурах. Положительным полюсом элемента служит чистая ртуть, покрытая слоем пасты из сернокислой закиси ртути, тщательно смешанной с ртутью. Отрицательный полюс – амальгама, содержащая 12.5% кадмия (по весу). Электродвижущая сила стандартного элемента между 15о и 25о равна 1.0183 + 0.000004 (20 – to).
Для определения рН применяются чувствительные стрелочные гальванометры. Вр время измерения ток не должен непрерывно проходить через прибор. Гальванометр может быть заменен капиллярным электродом.
Каломелевые электроды употребляются в качестве стандартных полуэлементов. Они состоят из ртути и каломели, над которыми находится раствор хлористого калия. Слой чистой ртути помещают на дно электродного сосуда. На ртуть помещают слой, состоящий из ртутно-каломелевой пасты. Эта смесь получается при совместном растирании ртути и каломели так, чтобы ртуть пришла в мелко раздробленное состояние. Черную или серочерную смесь промывают несколько раз раствором хлористого калия, которым намерены наполнить сосуд. Удобной формой каломелевого электрода является сосуд, изображенный на рис.
В зависимости от того, какой концентрации взят раствор для наполнения сосуда каломелевого электрода, их обозначают 0.1 н., 1.0 н., 3.5 н., или насыщенный каломелевый электрод.
Разность потенциалов всех стандартных электродов отнесена к нормальному оригинальному водородному электроду. Он равняется:
для 0.1 н. каломелевого электрода . . . . . . . . . . 0.3380 + 0.00006 (to – 18)
для 1.0 н. каломелевого электрода . . . . . . . . . .0.2864
для 3.5 н. каломелевого электрода . . . . . . . . . . 0.2549
для насыщенного каломелевого электрода . . . 0.2503
Снаряжение каломелевого электрода.
Изготовленный сосуд наполняют до краев хромовой смесью и оставляют на 24 часа. Стеклянную трубку с вплавленной в нее платиновой проволокой также выдерживают 24 часа в этой смеси. Затем сосуд и стеклянную трубку с платиновой проволокой промывают сначала в водопроводной воде, а затем в дистилированной. Кран на боковой трубке не смазывают вазелином, чтобы замыкание происходило через смоченный шлиф даже при закрытом кране. Вода перегоняется дважды; каломель, хлористый калий и металлическая ртуть должны быть специально очищены.
В сосуд наливают ртути столько, чтобы ею была вполне покрыта платиновая проволока трубки, затем смазывают штиф и плотно вставляют стеклянную трубку, ее больше не вынимают. Сосуд укрепляют в горизонтальном положении. После этого в фарфоровой ступке растирают несколько граммов каломели с приготовленным раствором хлористого калия (0.1 н. и нормального или насыщенного); после некоторого времени стояния раствор сливают, приливают его вновь; растирание и сливание повторяют несколько раз. Затем кашицу из каломели наносят тонким слоем на ртуть, всасывая через боковую трубку (для этого пользуются верхним краном) вместе с небольшим количеством раствора хлористого калия. После того как каломель осядет, сосуд на 2/3 также путем всасывания наполняют соответствующим раствором хлористого калия (при наполнении насыщенным раствором хлористого калия необходимо, чтобы на каломели были кристаллы этой соли). Во всех случаях заботятся о том, чтобы в боковой трубку не было пузырька. Иногда в изгибе трубку делают небольшое раздутие для улавливания пузырька воздуха.
Хингидронный электрод может заменить собой водородный электрод. Хингидрон представляет собой растворимый в воде (в незначительных количествах) порошок, состоящий из соединения хинона и и гидрохинона в эквимолекулярных количествах.
При растворении хингидрон распадается на свои составные части, причем между ними устанавливается динамическое равновесие
С6Н4О2 + Н2 « С6Н4О2Н2
хинон гидрохинон
Следовательно, хингидронный электрод можно рассматривать как электрод, обладающий весьма малым давлением водорода. Потенциал хингидронного электрода меняется с изменением концентрации водородных ионов, так же, как и потенциал водородного электрода. Разность потенциалов между хингидронным и насыщенным каломелевым электродами составляеит 0.4541 В.
Электрод представляет собой кусок проволоки или пластинки из платины (гладкой). Для измерения электрод погружают в раствор (5 – 10 мл), взболтанный в течение 30 секунд с 10 – 50 мг хингидрона. Электрод перед употреблением предварительно очищаю нагреванием с хромовой смесью и до определения сохраняют в ней.
Приготовление хингидрона.
100 г железных квасцов растворяют в 300 мл воды при 65о этот раствор выливают в раствор 25 г гидрохинона в 300 мл воды. Кристаллы хингидрона осаждаются в виде тонких игл. После охлаждения льдом их отсасывают. Выход 15 г. После перекристаллизации из воды этот хингидрон содержит только следы железа.
Ход определения.
Для приготовления вытяжек берут навеску муки семян 10 г и смешивают с 100 мл хорошо прокипяченной дистилированной воды. После часа стояния хорошо взбалтывают, дают отстояться и набирают пипеткой с обрезанным или оплавленным кончиком, в который вставлен плотный тампон (для фильтрования), несколько миллилитров экстракта. Листья, плоды, клубни измельчают на мясорубку (иногда два раза) и указанной выше пипеткой отбирают 20 – 30 мл сока. Удобно бывает предварительно отжать мезгу. Раствор или сок наливают в химический стакан на 50 – 100 мл (удобнее пользоваться пробиркой с конусовидным дном), насыпают в него щепотку хингидрона (чтобы после взбалтывания оставался осадок), опускают в него вычищенный платиновый электрод, который соединен с подвижным контактомю Измеряемый элемент состоит из двух электродов стандартного полуэлемента, соединенного с исследуемым электродом (раствором, соком), в который прибавлено немного кристаллов хингидрона (хингидронный электрод). В этот же стакан вставляют дугообразную трубку, наполненную раствором хлористого калия и агар-агара в воде. Другой конец ее опущен в промежуточный сосуд с насыщенным раствором хлористого калия; в этот сосуд опущен каломелевый электрод (малая цепь). После этого включают цепь и при помощи подвижного контакта находят нулевое положение контакта на линейке. Затем включают в малую цепь нормальный элемент Вестона и находят нулевое положение, передвигая для этого скользящий контакт.
Так как электродвижущая сила элемента Вестона известна, то ЭДС испытуемого хингидронно-каломелевого элемента находят по формуле
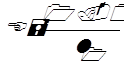 при 18 градусах Цельсия,
при 18 градусах Цельсия,
где l – отсчет длины отрезка по линейке при включении в цепь испытуемого элемента (сок, вытяжка), l1 – отсчет при включении элемента Вестона.
Повторив определение с новой порцией раствора, берут среднее и вычисляют рН по формуле:
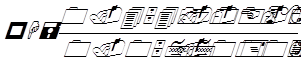 ,где
,где
0.00068(t-18) и 0.0002(t-18) являются температурными поправками.
Сильнокислая среда – рН 0 – 3, слабокисла – рН 4 – 6, слабощелочная – рН 8 – 10, сильнощелочная – рН 11 – 14, нейтральная – рН 7.
Принципы измерения с двумя реостатами (магазинами сопротивлений). Вместо измерительной линейки удобной пользоваться установками с магазинами сопротивлений. В большой круг (рис. ) включены реостаты 1 и 2 на 1000 или 1100 Ом каждый, в малый круг – реостат 2. В реостате 1 все ключи сняты, следовательно включено 1000 Ом, а в реостате 2 все ключи в своих гнездах, и ток через реостат проходит без сопротивления. Если же из реостата 2 мы переставим ключи в соответствующие места реостата 1, то этим введем сопротивление в малом круге цепи, не изменив общего сопротивления в большом круге цепи.
Ход определения сводится к тому, чтобы довести сопротивление в малой цепи до компенсации тока в большой цепи. Для этого в малой цепи при включенном стандартном элементе увеличивают сопротивление путем перестановки ключей из реостата 2 в такие же гнезда реостата 1 (включая на мгновение гальванометр). Ключи подбирают до тех пор, пока гальванометр не покажет отсутствие тока. Тогда подсчитывают введенные сопротивления, суммируя сопротивления (в омах) в магазине 2, и записывают. Затем включают испытуемый каломельно-хингидронный электрод и точно таким же образом достигают полной компенсации тока перестановкой ключей. Подсчитав, записывают новое сопротивление в магазине 2. По формуле узнают ЭДС испытуемого элемента:
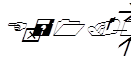 ,
,
где а – сопротивление в омах при включении испытуемого раствора, б – сопротивление при включении нормального элемента, Е – электродвижущая сила в вольтах. Упрощенная формула:
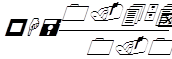 ,
,
где 0.4541 – разность потенциалов хингидронного и насыщенного каломелевого электрода.
В цепи, где разность потенциалов между раствором и металлом определяется водородными ионами, одной единице рН соответствует потенциал около 58 мВ (0.058 В).
2.5н NaOH – 0.05 н
5 мл NaOH – 245 мл H2O
Vhcl (0.1000) = 5мл (v naoh = 10.6, 10.7)
Навеска ябл.
зел – 2г. титровалось 2.6, 2.6
кр – 2г титровалось 3.6, 3.7
